Thèse présentée à la Faculté
des sciences de l'Université de Paris
pour obtenir le grade de
Docteur de l'Université
par
Sidney Christopher Alford
Synthèse
de nouvelles benzofurannopyrones (a et g) dérivées de l'euparine
soutenue le 12 juin 1966
devant la commission d'examen :
Normant, H., président
Mentzer, C., Maitte, P., examinateurs
L'euparine (I) a été isolée pour la première fois par Lloyd
des racines d'une eupatoire (Eupatorium purpureum) aux environs de 1870.
Par la suite la même substance a été extraite également des racines de E.
cannabinum qui renferme jusqu'à 0,5 % par rapport au poids sec. La structure,
établie dès 1959 par Robertson et coll., vient tout récemment d'être vérifiée
par une synthèse totale. Il existe dans le règne végétal un certain nombre
d'analogues structuraux de l'euparine : la trémétone (II), l'hydroxytrémétone
(III), la. déshydrotrémétone (IV) et le toxol (V).
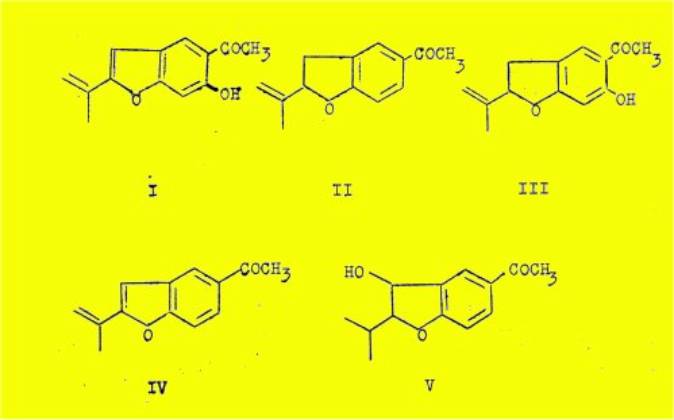
Ces quatre substances ont été découvertes récemment
(1961-1963), ce qui explique le petit nombre de publications consacrées à leur
étude.
L'eupatoire (E. cannabinum) est une plante très
commune dans nos régions. Elle se multiplie d'une façon particulièrement aisée
au bord des rivières et dans les terrains humides. D'autre part, étant donné
que ses racines sont relativement riches en euparine-, nous avons pensé que le
procédé d'extraction décrit dans la littérature devait nous permettre de
préparer assez facilement cette substance. Auparavant, et à une époque où le
mémoire de Ramachandran et coll. n'avait pas encore été publié, nous avions
entrepris des essais de synthèse totale qui s'étaient révélés fort laborieux et
qui d'ailleurs n'ont pas été poursuivis jusqu'au bout.
Le principal objectif de nos recherches a été la synthèse de
dérivés de l'euparine qui,.tout en n'ayant pas encore été découverts dans la
Nature, ont cependant beaucoup de chances d'être élaborés par certains
végétaux. Il s'agit en particulier de systèmes hétérocycliques comprenant dans
leur molécule un noyau furannique ou dihydrofurannique substitué en position 2
par un radical isopropényle ou isopropyle. Si on connaît dès maintenant un
certain nombre de représentants du groupe des furocoumarines, en particulier la
marmésine et la nodakénétine (VI), la xanthoxylétine (VII) et la peucédanine
(VIII), tous les quatre apparentés à 1'euparine, aucune furoflavone naturelle de
cette famille n'a été isolée jusqu' à présent.
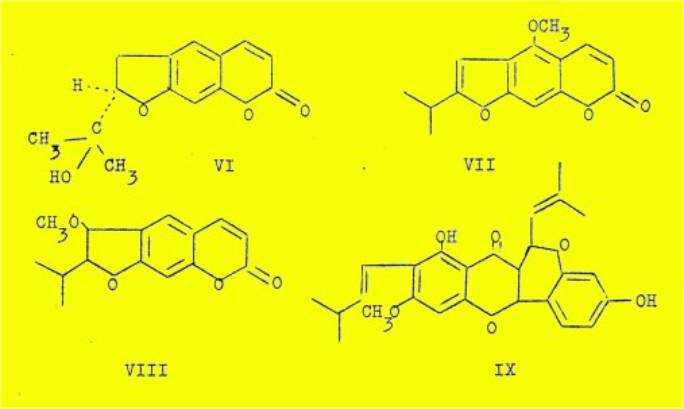
On pourrait à la. rigueur considérer 1'isoartocarpine (IX)
comme un précurseur d'un représentant de ce groupe, dans lequel la méthylation
du groupement OH en 7 aurait empêché la fermeture du cycle furannique. La
synthèse de tels composés n'a pas non plus été décrite - à notre connaissance
au moins. Aussi avons nous pensé que l'obtention d'édifices moléculaires de ce
type pourrait présenter un intérêt car ces substances sont susceptibles d'être
utilisées comme échantillons de référence, au fur et à mesure de leur isolement
en partant des végétaux.
Les raisons qui nous permettent de croire que les
furoflavones existent effectivement dans les plantes sont d'ordre biogénétique.
En effet les filiations entre les orthohydroxyacétophénones et les flavones par
l'intermédiaire des chalcones correspondantes sont connues depuis longtemps.
Jusqu'ici, chaque fois que le squelette d'une telle cétone était signalé dans
un genre déterminé, il a pu être établi que la flavone apparentée existait
également dans la Nature. Ainsi le squelette de 1'orthohydroxyacétophénone (X)
correspond à celui de la flavone non substituée, isolée du genre
"Primula" (XI) ; celui de la résacétophénone (XII) et de la
phloracétophénone (XIV) correspondent respectivement au pratol (XIII) et à la
chrysine (XV).
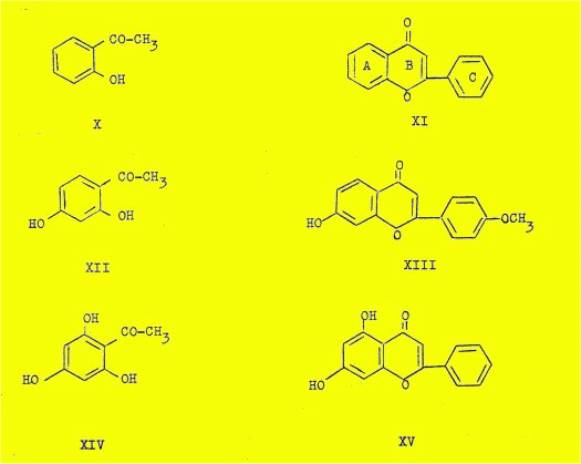
En fait, le nombre de cétones connues étant beaucoup moins
élevé que celui des flavones, chacune de ces cétones correspond effectivement à
une pluralité de flavones diversement substituées sur le noyau B et C par des
groupements hydroxyles ou méthoxyles. Ces considérations nous permettent de
prévoir l'existence de toute une série de furoflavones ayant la structure
(XVI), et dont la synthèse partielle est le but principal de ce travail.
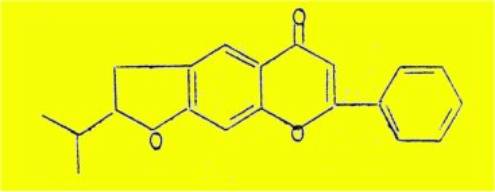
XVI
Notre thèse a comme sujet l'étude de la préparation d'une
série de substances hétérocycliques apparentées à l'euparine, acétophénone
naturelle qui a été isolée de plusieurs espèces d'Eupatorium. Ce genre est bien
représenté parmi les plantes ayant une action physiologique suffisamment
notoire pour avoir pris place dans la médecine populaire. Nous pouvons citer : Eupatorium
cannabinum ("Eupatoire chanvrine, Eupatoire d'Avicenne,
Pantagruelion"), E. purpureum (E. verticillatum Willd.,
"Gravel-root"), E. Perfoliatum, E. ayapana
("Aya-Pana") et E. crenatum.
E. cannabinum : répandue dans toute l'Europe tempérée et l’Afrique du Nord ; une
décoction de la racine fraîche est employée comme purgatif et une infusion des
feuilles comme tonique. E. purpureum : les racines servaient dans le
Nord de l’Amérique comme astringent et diurétique. E. perfoliatum:
abondant en Floride où les feuilles et les fleurs occupaient une place dans la
Pharmacopée Officielle comme tonique et vermifuge. E. aya-pana :
employée en Amérique du Sud comme stimulant ; laxative en forte dose. E.
crenatum : fait partie d'un groupe de plantes dites "guacos"
employées dans l’Amérique du Sud contre les morsures de serpents et les piqûres
de scorpions.
Par analogie avec d’autres acétophénones élaborées par des
plantes d'où l'on a extrait également les dérivés flavoniques correspondants,
nous pouvons soupçonner l'existence, à l'état naturel, de flavones dérivées de
l'euparine, bien qu'aucune n'ait été isolée jusqu'ici, à notre connaissance
tout au moins. Nous espérons que leur isolement et leur identification
éventuels seront facilités par nos recherches.
Celles-ci ont eu pour objet la préparation de quelques
substances flavoniques, ainsi que de quelques coumarines, ayant toutes en
commun le groupement isopropénylbenzofuranne ou ses dérivés partiellement ou
complètement hydrogénés. Or, la synthèse totale de ces composés hétérocycliques
est rendue difficile par les nombreuses étapes et les mauvais rendements
observés pour l'obtention de la partie benzofurannique de ces molécules. Il
nous a paru, par conséquent, très avantageux de prendre 1'euparine naturelle
comme matière première ou, encore mieux, son dérivé tétrahydrogéné qui, par
l'absence de liaisons conjuguées, devait simplifier beaucoup les réactions.
Notre premier chapitre concerne l'extraction de 1'euparine
de l'Eupatorium cannabinum et sa conversion en tétrahydroeuparine. Nous
avons pu arrêter la réaction d'hydrogénation à mi-chemin, ce qui nous a permis
d'isoler un dérivé nouveau : la dihydroeuparine. Sa non-identité avec
l'hydroxytrémétone, isolée de l'Eupatorium urticaefolium, indique
qu'il s'agit d'un isomère structural auparavant inconnu. La condensation de
1'euparine avec plusieurs aldéhydes aromatiques est également décrite dans le
premier chapitre. Une série de nouvelles chalcones en est résultée. Outre ces
chalcones, 1'euparine nous a permis de préparer d'autres corps hétérocycliques
qui ne correspondent pas à cette catégorie. En particulier, elle s'est
condensée avec l'aldéhyde cinnamique. Dans ce cas il nous a fallu modifier le
mode opératoire car les conditions utilisées pour la formation des chalcones ne
donnaient pas de résultat. Or, c'est en employant la pipéridine comme
catalyseur que la condensation s'est produite le plus facilement ; le produit
ainsi obtenu, de même que ses dérivés, montre une nette ressemblance avec des
roténoïdes. Nous pensons qu'il serait très intéressant de généraliser l'emploi
des catalyseurs du type Knoevenagel pour la préparation des chalcones en
général. Au cours de ce travail nous avons souvent fait appel au réactif de
King et White qui donne des couleurs intenses avec les substances flavoniques.
Une modification de cette réaction nous a fourni une méthode nouvelle
permettant de discerner, parmi les o-hydroxyacétophénones, celles qui sont
susceptibles de se transformer en chalcones.
La formation de dérivés de la tétrahydroeuparine constitue
le sujet de notre deuxième chapitre. Sa condensation avec des aldéhydes
aromatiques s'est montrée aussi facile qu'avec 1'euparine elle-même, mais les
chalcones ainsi formées se prêtent plus facilement que celles de l'euparine à
des transformations ultérieures. Elles se montrent, par exemple, susceptibles
de se cycliser en flavanones. Une nouvelle technique a été mise au point pour
réaliser cette isomérisation instantanément et à froid. Elle présente
l'avantage d'éviter le long reflux habituellement nécessaire et d'augmenter le
rendement. En ce qui concerne la transformation des chalcones en flavones nous
avons utilisé trois méthodes : la méthode classique due à Kostanecki - qui,
selon la température et la nature des substituants, conduit parfois à des
aurones - et deux méthodes plus récentes pour servir de preuve : l'une par
monobromuration de la flavanone, puis déshydrobromuration ; l'autre par
oxydation de la chalcone au moyen de l'anhydride sélénieux. L'eau oxygénée est
utilisée pour l'oxydation d'une chalcone en flavonol.
Dans le troisième chapitre nous traitons des coumarines
dérivées de l'euparine, de la dihydroeuparine et de la tétra-hydroeuparine. La
réaction de Boyd et Robertson nous a con-duit à des hydroxy-4 coumarines qui se
sont prêtées à la formation des dicoumarols par condensation avec du formol.
Nos essais en vue de remplacer cet hydroxyle en 4 par un atome d'halogène n'ont
donné, que des produits mal définis ; la tosylation, par contre, s'est montrée
facile et, par réduction d'une coumarine tosylée, nous avons obtenu une
coumarine non substituée en position 4, très apparentée aux coumarines
naturelles telles que la marmésine, la nodakénétine et la peucédanine.
Le quatrième chapitre décrit la préparation d'une flavone
par condensation thermique d'un phénol, 1'isopentyl-4 résorcine, avec le
benzoylacétate d'éthyle selon Mentzer. On peut considérer ce phénol comme un
dérivé hexahydrogéné de l'euparine. A ce titre, il nous a paru rationnel de
l'inclure dans notre travail. Obtenu directement par synthèse, sa condensation
avec l'ester représente une méthode élégante qui nous a permis de préparer une
nouvelle flavone en une seule étape. La transposition inattendue de celle-ci en
phényl-4 coumarine en présence d'acide sulfurique nous a fait entrevoir un
programme de recherches très intéressant. C'est, en, effet, le premier exemple
que nous connaissions d'une double scission C-C et C-O de telle façon que la
partie C6-C3 reste intacte.
Mots clefs : tétrahydroeuparine / synthèse / structure /
robertson / rendement / recherche / purpureum / préparation / peucédanine / perfoliatum /
nodakénétine / méthode / marmésine / isolement / hydroxytrémétone / hydroxyle /
furoflavone / furannique / flavone / flavanone / eupatorium / eupatoire / euparine /
crenatum / coumarine / condensation / chalcone / cétone / catalyseur / cannabinum /
aya-pana / aldéhyde / acétophénone / alford / normant